doi: 10.56294/evk202226
REVISIÓN
Lon adsorption behavior (in aqueous solutions) of lanthanum, cerium, and europium in organic adsorbents: review of kinetic, isothermal, and thermodynamic studies
Comportamiento de la adsorción de iones (en soluciones acuosas) de lantano, cerio, y europio en adsorbentes orgánicos: revisión de estudios cinéticos, isotérmicos y termodinámicos
Roxana Alejandra Ramirez Moriano1, Jacqueline Corredor Acuña1
1Universidad de Pamplona, Facultad de Ingenierías y Arquitectura, Departamento de Ingeniería Ambiental, Civil y Química. Pamplona, Colombia.
Citar como: Ramirez Moriano RA, Corredor Acuña J. Lon adsorption behavior (in aqueous solutions) of lanthanum, cerium, and europium in organic adsorbents: review of kinetic, isothermal, and thermodynamic studies. eVitroKhem. 2022; 1:26. https://doi.org/10.56294/evk202226
Enviado: 29-08-2021 Revisado: 19-12-2021 Aceptado: 03-03-2022 Publicado: 04-03-2022
Editor: Prof.
Dr. Javier Gonzalez-Argote ![]()
ABSTRACT
Rare earth elements are present in a large number of raw materials for different applications in high technology, including lasers, magnets, fiber optics, X-ray machines, and lamps. Therefore, efforts have been made to find new alternatives that improve the recovery and recycling of these important elements, given that rare earth reserves worldwide are scarce and highly polluting. The aim is to counteract demand and help the environment by using alternative methods and making use of waste at the end of its useful life. Some of this waste is found in water sources from treatment plants and mining, which is significantly dangerous for nature and humans. As a viable alternative, the adsorption method has been chosen as it is an effective and low-cost process. This document aims to analyze different literature on the adsorption of lanthanum, cerium, and europium ions (in aqueous solutions) on organic adsorbents such as biomass and activated carbons, in order to verify whether the adsorption technique proves to be effective for the recovery of these elements, analyzing the kinetic, isothermal, and thermodynamic models. The results obtained confirm that the parameters that depend on adsorption are contact time, pH, and temperature, with a high capacity for removing metal ions. The isotherms most used by the different authors were Langmuir and Freundlich. For the kinetic study, a correlation was found with the activation energy taking place in chemisorption. Most of the literature studied showed that these were spontaneous and endothermic processes.
Keywords: Bioadsorbents; Chemical Equilibrium; Physisorption; Chemisorption; Rare Earths.
RESUMEN
Los elementos de tierras raras están presentes en una gran cantidad de materia prima para diferentes aplicaciones en la alta tecnología, entre ellas se encuentra los láseres, imanes, fibra óptica, máquinas de rayos X y lámparas, por lo que se ha tratado de encontrar nuevas alternativas que mejoren la recuperación y el reciclaje de estos elementos tan importantes, debido a que las reservas de tierras raras en todo el mundo son escasas y son sumamente contaminantes, se busca contrarrestar la demanda y ayudar al medio ambiente acudiendo a métodos alternativos y dándole uso a los desechos al final de su vida útil, algunos de estos desechos se encuentran en fuentes hídricas provenientes de plantas de tratamiento y de minería, lo que es significativamente peligroso para la naturaleza y los seres humanos. Como alternativa viable se ha optado por el método de adsorción ya que es un proceso eficaz y de bajo costo, este documento tiene como objetivo analizar diferente literatura sobre adsorción de iones (en soluciones acuosas) de lantano, cerio, y europio en adsorbentes orgánicos como biomasa y carbones activados, con el fin de verificar si la técnica de adsorción demuestra ser eficaz para la recuperación de estos elementos, analizando los modelos cinéticos, isotérmicos y termodinámicos. Los resultados obtenidos comprueban que los parámetros que dependen de la adsorción son el tiempo de contacto, el pH, y la temperatura teniendo una gran capacidad de remoción de iones metálicos, las isotermas más utilizadas por los diferentes autores fue Langmuir y Freundlich, para el estudio cinético se encontró la correlación con la energía de activación tomando lugar en la quimisorción, la mayoría de la literatura estudiada resultó ser procesos espontáneos y endotérmicos.
Palabras clave: Bioadsorbentes; Equilibrio Químico; Fisisorción; Quimi Sorción; Tierras Raras.
INTRODUCCIÓN
Los elementos de tierras raras (rare earth elements, REE) son un grupo de metales especiales compuestos por diecisiete elementos, quince de ellos ubicados en el grupo de los lantánidos que contienen propiedades químicas, magnéticas y luminiscentes únicas y diversas que los hacen significativamente importantes en una serie de industrias de alta tecnología debido a sus diversos usos en imanes permanentes de alta resistencia, láseres, convertidores catalíticos automotrices, fibra óptica / superconductores y dispositivos electrónicos.(1,2) Este grupo de elementos se divide en dos clases, LREE y HREE, donde el primero se encuentra compuesto por cerio (Ce), lantano (La), neodimio (Nd), praseodimio (Pr), samario (Sm), europio (Eu), prometio (Pm) y el segundo incluye gadolinio (Gd), terbio (Tb), disprosio (Dy), tulio (Tm), iterbio (Yb), lutecio (Lu), holmio (Ho) y erbio (Er).(3)
Actualmente China produce más del 90 % de elementos de tierras raras incluyendo el depósito de Bayan Obo que cuenta con una reserva de REE de más de 57,4 millones de toneladas métricas pero no es totalmente grande para mitigar la demanda alrededor del mundo, por lo que el resto de países se enfrentan a un riesgo de suministro, dependiendo del reciclaje a partir de chatarra, residuos industriales y productos al final de su vida útil, por lo que será una necesidad absoluta buscar alternativas que sean rentables desde los puntos de vista económicos y medioambientales, lo que ocasionó que se pusieran en práctica métodos de separación y recuperación para conseguir elementos con purezas significativas.(4,5)
Existen varios métodos de separación de REE mediante técnicas convencionales que conllevan una gran desventaja debido a su alto consumo de energía y costo operativo como la purificación, la coprecipitación, la extracción con disolventes, y el intercambio iónico, por lo que se está estudiando otra alternativa como lo es la adsorción para la eliminación y recuperación de iones metálicos.
Entre las aplicaciones de elementos de tierras raras pesadas se encuentran: Calibración de longitud de onda de espectrofotómetro óptico e imán (Ho), máquina de rayos X portátil, lámpara de halogenuros metálicos y láser (Tm), Imán basado en Nd y aditivos en la unidad de disco duro (Dy), láser infrarrojo, acero al vanadio y fibra óptica (Er), para elementos de tierras raras ligeras se encuentran: Óptica, baterías, catálisis (La), Aplicaciones químicas, colorantes, catálisis (Ce), láseres, televisión en color, iluminación, aplicaciones médicas (Eu), esto hace que sean elementos primordiales para la recuperación buscando aprovechar desechos existentes.(6,7)
Los dos principales promotores de la demanda de REE son la tasa de crecimiento económico general y el nuevo desarrollo en las aplicaciones de materiales. Por ejemplo, las tecnologías sostenibles que incluyen REE han crecido drásticamente en las últimas dos décadas. El crecimiento más rápido ha sido la demanda de nuevas aplicaciones, incluidos imanes, fósforos, catalizadores y baterías, que ahora representan más del 60 por ciento de la demanda y continuarán creciendo, impulsadas por fuertes inversiones en energía limpia.(8)
Los REE no reciclados pueden ocasionar contaminación en aguas por culpa de desembocaduras de minería o plantas de tratamiento, afectando el medio ambiente y generando una necesidad de eliminación efectiva de estos elementos, para remediar las concentraciones altas que se encuentran en los ríos y quebradas se opta por un tratamiento novedoso como lo es la adsorción.
En esta monografía se realizará un estudio sobre el método de adsorción con adsorbentes orgánicos como biomasa y carbones activados de iones de lantano, cerio, y europios presentes en soluciones acuosas, resaltando estas nuevas alternativas ecológicas porque ayudan a mitigar los impactos adversos sobre el medio ambiente. Se centralizará en las isotermas de adsorción, los modelos cinéticos, y los parámetros termodinámicos (ΔGº, ΔHº, ΔSº, capacidad de adsorción (qe) y tiempos de equilibrio), revisando los últimos cinco años de la literatura al respecto.
¿Cómo contribuyen los adsorbentes orgánicos como la biomasa y los carbones activados a la eliminación eficiente de iones de lantano, cerio y europio en soluciones acuosas, considerando los modelos cinéticos, isotérmicos y parámetros termodinámicos según estudios recientes?
Objetivo
Realizar un estudio sobre la adsorción de iones (en soluciones acuosas) de lantano, cerio, y europio en adsorbentes orgánicos como biomasa y carbones activados, enfocado en los modelos cinéticos, isotérmicos y los parámetros termodinámicos, revisando los últimos cinco años de la literatura al respecto.
DESARROLLO
Elementos De Tierra Rara (REE)
Los elementos de tierras raras incluyen quince lantánidos, itrio y escandio, se encuentran en más de 250 minerales en todo el mundo. Los REE se utilizan en diversas aplicaciones de alta tecnología en diversas industrias, como la eléctrica y electrónica, la automoción, las energías renovables, la medicina y la defensa. Por lo tanto, la demanda de REE en el mercado global está aumentando día a día debido a la creciente demanda de varios sectores, como las economías emergentes y la tecnología verde.(9)
Lantano, Cerio y Europio pertenecen al grupo de lantánidos, este grupo está compuesto por quince elementos donde se encuentran divididos en dos (ligeros y pesados), los ligeros son más abundantes en la naturaleza por lo que se dice que los pesados están en estado crítico, en la figura 1. Se puede observar la distribución en la tabla periódica.

Figura 1. Distribución del grupo lantánido en la tabla periódica de los elementos químicos(10)
Los REE se encuentran juntos en la naturaleza a causa de sus propiedades fisicoquímicas similares, todos son iones trivalentes (estado de oxidación +3), con excepción del Ce+4 y el Eu+2. Esta similitud permite la sustitución de los REE entre sí en varias redes cristalinas, por esto se presentan múltiples elementos de este grupo en un mismo mineral. Este conjunto de elementos químicos tiene propiedades magnéticas, ópticas, conductivas, específicas que los hacen únicos, y por lo mismo tan requeridos por la industria.(10)
Los elementos de tierras raras no son tan raros como su nombre lo indica, la mayoría de los LREE tienen abundancias similares en la corteza terrestre tanto como la mayoría de los metales industriales, como cromo, níquel, cobre, zinc, estaño, tungsteno o plomo.(9,11)
|
Tabla 1. Características de los elementos de tierra rara estudiados La, Ce y Eu |
|||
|
Características |
Cerio |
Lantano |
Europio |
|
Símbolo atómico |
Ce |
La |
Eu |
|
Número atómico |
58 |
57 |
63 |
|
Peso atómico (g / mol) |
140,115 |
138,9054 |
151,965 |
|
Punto de fusión (°C) |
795 |
920,9 |
822 |
|
Punto de ebullición (°C) |
3443 |
3456,9 |
1529 |
|
Valencias |
+3, +4 |
+3 |
+3, +2 |
|
Propiedades |
Metal reactivo y gris que se empaña en el aire y se quema cuando se calienta. |
Elemento metálico blando y dúctil de color blanco plateado que se empaña rápidamente en el aire. |
Es un metal dúctil y tiene el segundo punto de fusión más bajo y la densidad más baja de todos los elementos de tierras raras. |
|
Descubridor |
Wilhelm von Hisinger, J. Jacob Berzelius, Martin Klaproth. (1803). |
Carl Gustaf Mosander (1839). |
Paul Émile Lecoq de Boisbaudran (1890). |
|
Referencia |
(13) |
(14) |
(12) |
Estos elementos tienen diferentes aplicaciones por ejemplo el europio se ha utilizado como dopante en cristales láser y como material fluorescente en televisores de tubo de rayos catódicos y lámparas fluorescentes, el lantano suele ser utilizado en baterías, catálisis entre otros, el cerio es utilizado en colorantes, y en catálisis.(7,12) Algunas de las características más importantes para estos elementos se encuentran descritos en la tabla 1.
Fundamentos de adsorción
La adsorción ha recibido una atención y aceptación notable debido a su bajo costo, siendo un proceso sencillo y ecológico. La IUPAC define la adsorción como “el aumento en la concentración de una sustancia en el interfaz de una capa condensada y una líquida o gaseosa debido a la operación de las fuerzas superficiales “. Las moléculas de soluto (adsorbato) se caracterizan por ser una sustancia en fase sólida, líquida o gaseosa, que será adsorbida, y la sustancia en la que se adsorbe el adsorbato recibe el nombre como adsorbente.(15) El mecanismo de adsorción se describe gráficamente en la figura 2.

Figura 2. Modelo gráfico proceso de adsorción
El proceso de adsorción se clasifica de dos maneras, fisisorción y quimisorción, estos fenómenos se relacionan dependiendo su naturaleza, la primera depende de las fuerzas débiles como lo son las fuerzas de van der Waals, por lo general la adsorción física se da en multicapas y ocupa todos los sitios de adsorción; la segunda depende de la formación de enlaces químicos entre adsorbato y adsorbente formando una sola capa y ocupando solo un sitio en la superficie, en la tabla 2. Se encuentra un breve resumen y diferencias entre estos dos fenómenos.(15)
|
Tabla 2. Diferencias entre fisisorción y quimisorción |
||
|
Fisisorción |
Quimisorción |
Referencia |
|
Reversible |
Irreversible |
(16) |
|
Interacciones de van der Waals entre un átomo o molécula adsorbidos y las moléculas en una superficie sólida. |
Enlaces químicos covalentes entre un átomo o molécula adsorbidos. |
(13) |
|
Multicapas |
Monocapa |
(17) |
|
Depende linealmente de la temperatura. |
Depende exponencialmente de la temperatura (Ecuación de Arrhenius) |
(18) |
|
Entalpía de adsorción inferior a 40 KJ/mol. |
Entalpía de adsorción superior a 80 KJ/mol. |
(18) |
|
La cuantía de la adsorción sobre una superficie depende más de la sustancia que se adsorbe que del adsorbente. |
La cuantía de la adsorción depende de la sustancia que se adsorbe y del absorbente. |
(18) |
|
La adsorción sólo es apreciable a temperaturas inferiores a las de ebullición de la sustancia que se adsorbe. |
La adsorción se produce también a temperaturas elevadas. |
(18) |
Otra forma de describir la adsorción es como un fenómeno de superficie y se define como la transferencia de una masa de un líquido a un sólido, la cantidad de sustancias adsorbidas por un líquido o un sólido dependen de: la naturaleza de la sustancia a ser adsorbida, la naturaleza química de la sustancia adsorbente, el área superficial de la sustancia adsorbente, (a mayor porosidad, mayor adsorción), la temperatura, la concentración de la sustancia.(18)
La adsorción es un mecanismo más lento que depende en gran medida de la composición del adsorbente, generalmente es irreversible debido a las grandes fuerzas que se producen entre el adsorbato y el adsorbente durante el proceso de adsorción. Los materiales que se pueden usar en el proceso van desde sustratos naturales o biosorbentes que incluyen raíces, cortezas y hojas, además de sorbentes sintéticos como carbón activado, óxidos metálicos, entre otros.(19)
Los estudios de adsorción generalmente contienen cinéticas de adsorción, isotermas y termodinámicas. Los parámetros termodinámicos están descritos por el cambio de energía libre de Gibbs estándar (∆G°), cambio en entalpía estándar (∆H°) y cambio en entropía estándar (∆S°) ofreciendo información útil para expresar el comportamiento de adsorción.(20)
La literatura que se estudió pertenece a procesos de adsorción por lotes, Geankoplis establece que este método por lotes se utiliza para adsorber solutos de disoluciones líquidas cuando las cantidades tratadas son pequeñas, este proceso por lotes también se puede utilizar en la industria farmacéutica y en otras. Al igual que en muchos otros procesos, se necesita una relación de equilibrio como lo es las isotermas de Freundlich o de Langmuir y un balance de materia.(21)
Modelado de equilibrio de adsorción
En el proceso de eliminación de metales pesados como elementos de tierras raras por medio de la adsorción, es de gran importancia para comprender e identificar un modelo de diseño adecuado para ello se tienen en cuenta la cinética, las isotermas y los parámetros termodinámicos como ΔGº, ΔHº, ΔSº, qe (capacidad de adsorción) y tiempos de equilibrio.
En cuanto el proceso de adsorción comienza, las moléculas de adsorbato comienzan a adsorberse en la superficie (adsorbente) generando una velocidad, al aumentar el tiempo en el proceso se comienza a evidenciar una disminución de la velocidad de adsorción y un aumento en la velocidad de desorción, esto ocurre hasta lograr un equilibrio entre las dos situaciones. La correlación de los datos de equilibrio ya sea mediante ecuaciones teóricas o empíricas, es esencial para el diseño práctico y el funcionamiento de los sistemas de adsorción.
El equilibrio que se forma en este proceso es llamado, también, isotermas de adsorción proporcionando información como la cantidad de iones adsorbidos, esta es la fuente principal de información sobre el proceso de adsorción y es fundamental para optimizar el uso de adsorbente porque describe cómo un adsorbato interactúa con un adsorbente.(22)
La capacidad de adsorción se puede calcular a partir de la ecuación 1. Dependiendo de un balance de masa entre las concentraciones, el volumen y la cantidad de adsorbente.
Ecuación 1. Capacidad de adsorción
𝑞𝑒= (𝐶0−𝐶𝑒)∗𝑣𝑚
Donde:
qe es la capacidad de adsorción (mg /g), C0 y Ce (mg / L) es la concentración inicial del adsorbato y la concentración en el equilibrio respectivamente, v hace referencia al volumen (L) y m es la cantidad de adsorbente (g).(23)
Cinética y energía de activación de adsorción
Largitte L. et al.(24) explican los pasos que ocurren en el proceso de adsorción, estos son muy importantes debido a que se pueden adecuar los modelos cinéticos dependiendo del paso del proceso, estos se dividen en tres, en el primero ocurre la transferencia de masa externa del adsorbato de la solución a la superficie externa del adsorbente, en el segundo ocurre la difusión interna del adsorbato a los sitios de sorción y finalmente la tercera etapa ocurre la adsorción en sí. El modelo cinético que aplica para la difusión en transferencia de masa externa como el proceso más lento viene dado por la ley de Fick, en contraste con esto, la difusión interna como paso más lento puede utilizar el modelo de Manivela, por último si el paso más lento ocurre en la adsorción los modelos que se pueden aplicar vienen siendo de pseudo primer orden, pseudo segundo orden, Elovich y Langmuir que usualmente aplica para la eliminación de iones metálicos; La adsorción suele ser el proceso más lento cuando la absorción de adsorbato en el adsorbente es de naturaleza química en otras palabras quimisorción.
La ecuación pseudo primer orden y pseudo segundo orden se expresan de la siguiente forma:

Donde:
qt es la cantidad adsorbida en el tiempo (mg/g), k1 es la constante de velocidad de pseudo primer orden (min - 1), k2 es la constante de velocidad de pseudo segundo orden y t es el tiempo (min).(3)
El estudio cinético de adsorción es importante para establecer los parámetros de diseño del proceso y la aplicación de recuperación de REE, las tasas de adsorción y la energía de activación del proceso.(25) La energía de activación (Ea) indica la relación en el proceso de adsorción entre el adsorbente y el ion metálico rectificando si la reacción ocurre de manera física o química. Para obtener la energía de activación se realizan estudios de la variación de la capacidad de adsorción con el tiempo a diferentes temperaturas.(26)
La quimisorción depende exponencialmente de la temperatura por lo que da paso al diagrama de Arrhenuis en base a la relación de la constante de velocidad, la ecuación empírica se describe como:

Donde:
k es la constante cinética, A es el factor preexponencial, Ea es la energía de activación (J /mol), R constante universal de los gases (8,314 J/mol.k) y T la temperatura (k).(26)
Linealmente la ecuación de Arrhenius adopta la forma:
![]()
Por medio de la ecuación 5. Se encuentra el valor de la energía de activación graficando lnk vs 1/T y la pendiente de esta línea toma el valor de -Ea/R.(26)
Isotermas de adsorción
El estudio de estas isotermas juega un papel importante debido a que nos proporcionan información de la capacidad máxima de adsorción, el mecanismo y las propiedades de los adsorbentes, estas se describen por la relación entre las concentraciones de adsorbato en equilibrio en fase líquida y la cantidad de adsorción en equilibrio en fase sólida a una determinada temperatura, con estos datos que nos proporcionan se pude delimitar y evaluar el desempeño de los adsorbentes.(17)
Existen bastantes modelos de isotermas, entre las más destacadas se encuentran los modelos de adsorción físicos y químicos, las isotermas químicas describen el proceso de adsorción de monocapa y las isotermas físicas representan la adsorción multicapa, entre los más conocidos se encuentra el modelo de Langmuir, Freundlich, Temkin, Sips, Volmer, entre otros. En este este estudio se profundizó solamente en los modelos de Langmuir, Freundlich, Temkin porque son los modelos comúnmente reportados en literatura.(17)
Isoterma de Langmuir
La isoterma de Langmuir es la isoterma ampliamente reportada en la literatura para la adsorción de iones metálicos, tintes, medicamentos y otras formas de contaminantes orgánicos en bioadsorbentes y adsorbentes abióticos seguidos por el modelo de Freundlich. Este modelo cuenta con las características enunciadas en la tabla 3.
Las isotermas de Langmuir son representadas por la siguiente ecuación:

Donde:
qe hace referencia a la cantidad de adsorción (mg de adsorbato/g de adsorbente), qm es la máxima capacidad de adsorción (miligramos/gramos), bL es la constante de Langmuir (Litros/miligramos) y Ce es el valor de la concentración en el equilibrio (miligramo/litro). Esta ecuación se resuelve por el método de regresión no lineal.
Este modelo pertenece a adsorción química debido a que ocurre en la monocapa, esto significa que las moléculas de adsorbato se adsorben en los sitios de adsorción de los adsorbentes.(27) La representación esquemática de este modelo se puede observar en la figura 3.

Figura 3. Mecanismo de adsorción modelo de Langmuir(27)
Isoterma Freundlich
Fue el primer modelo de isoterma propuesto por Herber Freundlich en 1906, lo determinó por medio de resultados experimentales. Este modelo describe el equilibrio de adsorción en superficies heterogéneas a través de adsorción en multicapas,(27) varios autores llegan a la misma conclusión y se basan en que esta ecuación es empírica por lo tanto se tomó para adsorciones heterogéneas.(28) Se representa por medio de la siguiente ecuación:

Donde:
qe es la capacidad de adsorción del soluto (mg adto/ g de adte), k F es la constante de adsorción de Freundlich a una concentración unitaria, n (adimensional) es la intensidad de adsorción, y Ce es la concentración en el equilibrio (mg/L), esta ecuación se resuelve por análisis de regresión no lineal.(27) Algunas características de este modelo se encuentran enunciadas en la tabla 1.
Isoterma Temkin
La isoterma de Temkin corresponde a un proceso de adsorción en la multicapa, incluyendo un factor donde se considera la interacción entre el adsorbente y adsorbato. Es un modelo adecuado para anticipar la adsorción en fase gaseosa.(27) Se representa por la siguiente ecuación:

Donde:
R es la constante de los gases, T es la temperatura, bT está relacionado con el calor de sorción (J/mol), KT es constante de Temkin, y Ce es la concentración en el equilibrio.(27) Algunas características de este modelo se encuentran enunciadas en la tabla 3.
|
Tabla 3. Características de los modelos de Isotermas |
|
|
Modelo |
Características |
|
Langmuir |
Es el más utilizado en la adsorción y se obtuvo estudiando premisas cinéticas, termodinámicas y análisis estadístico.(19) |
|
El adsorbato se adhiere a un solo sitio de superficie hasta que se adsorbe.(19) |
|
|
Una molécula de adsorbato está conectada a un solo sitio de superficie.(19) |
|
|
Con el aumento de la distancia desde el absorbente de superficie, la frecuencia de las fuerzas de atracción intermoleculares como las fuerzas de van der Waals, fuerzas ión-ión y los puentes de hidrógeno, disminuye.(19) |
|
|
Freunlich |
El modelo de Freundlich se ha considerado una ecuación empírica sin significado físico específico.(27) La adsorción puede ocurrir de forma química o física.(19) |
|
Se utiliza para representar el fenómeno de adsorción no lineal.(27) |
|
|
Temkin |
Se caracteriza por la distribución uniforme de energía hasta alcanzar la máxima energía de unión.(29) |
|
|
Este modelo plantea la hipótesis en la cual la disminución de la entalpía de adsorción hace aumentar el grado de recubrimiento sobre el adsorbente.(29) |
Parámetros termodinámicos de adsorción
La entalpía es una función termodinámica que suministra información de la energía en un sistema, es fundamentalmente importante para la geoquímica debido a su relación con la capacidad calorífica, su papel en definir y dar la dependencia de la temperatura de la energía libre y su relación con la entropía del entorno del sistema.
La entropía proporciona los criterios para pronosticar la dirección de los procesos naturales espontáneos y el estado de equilibrio de un sistema. La entropía es una función de estado, lo que significa que su valor está determinado por el estado de un sistema y es independiente del proceso.
El cambio de entalpía estándar y de la entropía estándar se pueden calcular por medio de la ecuación lineal de Van’t Hoff de acuerdo con las leyes termodinámicas Primera y Segunda combinadas por medio de la siguiente ecuación:

Un valor positivo de ΔH° demuestra que la adsorción es endotérmica, por lo contrario, valores negativos significan que el proceso ocurre de manera exotérmica.(19)
Un estado estándar en termodinámica representa valores de temperatura y presión de 298K y 1 atm, respectivamente, en esta fase estándar la energía de formación para un elemento es cero en estado normal.
Para hallar los valores de espontaneidad de los procesos se tiene en cuenta la siguiente ecuación:
![]()
Donde R es la constante de los gases, T la temperatura, y K0 indica el coeficiente de distribución y viene dado por K0 = qe/ce. Para valores de ΔG° negativos el proceso de adsorción ocurre de manera espontánea.(19)
Adsorción de iones en soluciones acuosas de lantano, cerio y europio en diferentes adsorbentes orgánicos.
Adsorción de lantano
Gallardo et al, estudiaron la adsorción de La (III) en soluciones acuosas, mediante un proceso que se llevó a cabo a una temperatura de 20ºC, evaluaron la cáscara de nuez (WS) como bioadsorbente. Para caracterizar el WS antes y después de la adsorción de REE se utilizó espectroscopia FTIR con la cual se identificó grupos funcionales, SEM que proporcionó información de la superficie del material y termogravimetría con el que se halló la cantidad de masa presente antes y después de la adsorción. Se ajustaron los valores de pH ácido en experimentos por lotes hasta encontrar que la condición óptima de adsorción fue de pH de 5,5, los modelos de isotermas comparados en este estudio fueron la de Freundlich, Langmuir y Temkin, todas las isotermas arrojaron una alta correlación, pero la que se tomó en cuenta es Freundlich con un ajuste mayor.(30)

Figura 4. El recuadro negro hace referencia al ion La, a) eficiencia de adsorción vs tiempo de contacto, b) eficiencia de adsorción vs concentración inicial(31)
Kusrini et al.(31) realizaron estudios de adsorción de La en soluciones acuosas partiendo de un bioadsorbente que proviene de desechos agrícolas, como fue la parte interna de la corteza de durián, obtuvieron parámetros importantes en la adsorción como el tiempo de equilibrio, pH, y la temperatura adecuada para la eliminación de este ión, teniendo como resultado una capacidad de adsorción de 71 mg de lantano por gramo de bioadsorbente por lo cual es conveniente mencionar que sería una alternativa viable en el campo de aguas residuales contaminadas con iones metálicos. En el proceso de preparación del adsorbente se retiró la corteza externa y el material interno se trituro hasta obtener trozos de aproximadamente 1cm, pasando a un proceso de secado y posteriormente moliéndolo para obtener partículas de aproximadamente 500 micrómetros. Al evaluar los modelos de isotermas se tuvieron en cuenta Langmuir y Freundlich y el que tuvo mejor correlación fue Langmuir; en la figura 4 se observa las gráficas que relacionan la capacidad de adsorción respecto al tiempo de contacto y la concentración inicial. Analizando los parámetros termodinámicos concluyeron que el proceso reportó ser de naturaleza exotérmica.
A mayor tiempo de contacto mayor fue el porcentaje de adsorción de La, en cambio a mayor concentración inicial la capacidad de adsorción disminuye. El aumento de la concentración de iones de La limita la interacción entre los iones metálicos y el adsorbente debido a la saturación del sitio activo del adsorbente. Por tanto, la adsorción óptima depende de la relación entre la concentración de iones metálicos y la dosis de adsorbente.(31)
Zhao et al.(32) estudiaron la adsorción de La (lll) utilizando un adsorbente de biocarbón derivado de paja de trigo como un material eficaz y económico en la recuperación de lantánidos, el experimento se llevó a cabo por lotes en un proceso discontinuo añadiendo diferentes cantidades de biocarbón, el pH estudiado fue de 5 teniendo características ácidas, se analizó la concentración de biocarbón antes y después de la adsorción, por último se analizaron dos modelos empíricos de isotermas de adsorción, Langmuir, Freundlich a tres temperaturas diferentes a 20, 40 y 60ºC, encontrando que la adsorción del proceso de eliminación de La (lll) aumentó con la temperatura, el modelo que más se ajusto fue el de Langmuir. Respecto a parámetros termodinámicos se calcularon ΔGº, ΔHº, ΔSº, siendo un proceso endotérmico y espontáneo.
A su vez Kusrini et al.(34) realizaron estudios en el año 2018 utilizando el bioadsorbente de pectina extraída de la cáscara del durian, el proceso de adsorción se llevó a cabo en forma discontinua donde se estudió el pH, la cantidad de pectina, el tiempo de contacto y la temperatura adecuada para la adsorción, en la figura 5 se observa gráficamente el porcentaje de adsorción respecto a la dependencia del tiempo de contacto y la concentración inicial, el pH que se adecuó al proceso de adsorción se encontró en un valor de 4, con un tiempo de equilibrio de adsorción de 90 minutos y se realizó diferentes pruebas con temperaturas de 25, 30, 40, 50 y 60 ° C donde se halló que la mejor adsorción fue en 25°C. Posteriormente se estudió las isotermas de Freundlich y Temkin ya que el proceso dio como resultado una formación heterogénea y de multicapas de modo que los iones de La se difundieron y penetraron en las diferentes capas a través de los poros en la superficie de las partículas de pectina. Por otro lado, se estudió la termodinámica de adsorción de lantano en la pectina dando como resultado un proceso exotérmico y espontáneo.

Figura 5. Eficiencia de adsorción vs A) tiempo de contacto, B) concentración inicial(33)
El porcentaje de adsorción aumentó con el paso del tiempo incrementando de forma no lineal hasta alcanzar el equilibrio, esto indicó que los iones de La ocuparon los sitios activos de la pectina, al pasar el tiempo los sitios se llenaron y pasaron a un estado de saturación en el equilibrio, por otro lado, a una concentración inicial de 80 ppm la eficiencia alcanzó la máxima capacidad de adsorción de aproximadamente 80 % y disminuyó al aumentar la concentración inicial.
Kosheleva A. et al.(34) estudiaron en 2018 la adsorción de La con un adsorbente de biomasa residual de microalgas (Chlorella sorokiniana) con quitosano y cascarilla de mijo, el quitosano se extrajo a partir de subproductos del proceso industrial de los crustáceos y concha del cangrejo. Los experimentos se llevaron a cabo por lotes donde la cantidad utilizada de adsorbente fue de 0,1 g, el pH que se estudió fue de 1,54 y 4,24, todo el proceso de adsorción se manejó a temperatura ambiente (20°C) y con un tiempo de contacto de 60 min, donde posteriormente llego al equilibrio y se estudió las isotermas de adsorción por medio del modelo de Langmuir y Freundlich, como resultado el modelo que mejor se ajustó fue el de Langmuir. Este bioadsorbente fue viable en la adsorción de La con una eliminación del ion metálico mayor al 80 %
En la tabla 4 se encuentra un resumen de los parámetros más importantes de adsorción reportados en la literatura con diferentes adsorbentes. Los valores de las ecuaciones de isoterma reportados por los diferentes autores se encuentra en la tabla 4.
|
Tabla 4. Recopilación de datos obtenidos en el estudio de adsorción de iones de Lantano en soluciones acuosas |
|||||||||
|
Adsorbente |
Ion Lantano |
pH |
Tiempo de equilibrio (min) |
Temperatura |
Cantidad de adsorbente (g) |
Isotermas |
qe (mg/g) |
C0 (mg / L) |
Referencia |
|
Cáscara de nuez. |
La (lll) |
5,5 |
720 |
20ºC. |
4x10-6 |
Freundlich |
7,16 |
Dato no reportado |
(30) |
|
Corteza de durian. |
La (lll) |
5 |
120 |
30ºC |
0,25 |
Langmuir |
80,3 |
80 |
(31) |
|
Biocarbón derivado de paja. |
La (lll) |
5 |
75 |
20 ºC |
Dato no reportado. |
Langmuir |
80 |
30 |
(32) |
|
Pectina extraída de la cáscara del durian. |
La (lll) |
4 |
90 |
25°C |
0,25 |
Freundlich ,Temkin. |
41,2 |
80 |
(33) |
|
Biomasa residual de microalgas con quitosano y cascarilla de mijo. |
La (lll) |
4,2 4 |
60 |
20ºC. |
0,1 |
Langmuir, Freundlich |
34,53 |
100 |
(34) |
Adsorción de Cerio
Uno de los adsorbentes orgánicos utilizados en la adsorción de Ce (lV) es el carbón activado desarrollado a partir de paja de arroz, una alternativa ecológica que ayuda a la adsorción de iones de cerio en soluciones acuosas. Los experimentos se llevaron a cabo en un sistema discontinuo donde evaluaron el pH, el tiempo de equilibrio, la temperatura óptima, la cantidad de adsorbente, el modelo cinético e isotermo. La capacidad máxima de adsorción se encontró en un valor de pH 4, con un tiempo de equilibrio de adsorción de 500 min, la temperatura es un factor significativo que influye en la adsorción de iones metálicos, en este estudio se realizaron muestras a diferentes temperaturas de 20, 25, 30, 35 y 40°C y se encontró que el rango de temperatura óptima donde se realiza la mayor adsorción de cerio es de 35 ºC a 40ºC con una base de adsorbente de 0,02g. Las isotermas de adsorción de iones de cerio se hallaron en laboratorio mediante ensayos por lotes, estos resultados se basaron en datos experimentales obtenidos por los modelos de adsorción de Langmuir y Freundlich y Temkin. La adsorción de cerio por carbón activado también depende de la concentración inicial de los iones, en la figura 7 se evidencia esta relación, la cantidad de cerio adsorbido sobre carbón activado aumentó directamente con la concentración inicial de iones metálicos hasta encontrar el cambio abrupto en el rango de 200 a 250 (mg/L) donde se evidencia claramente un estado constante en el que la cantidad de adsorción no mejora debido al aumento de la concentración.(35)
El modelo de adsorción que mostró mejores resultados de ajuste fue el de Langmuir obteniendo una representación lineal que se muestra en la figura 6.

Figura 6. Representación lineal modelo de Langmuir(35)
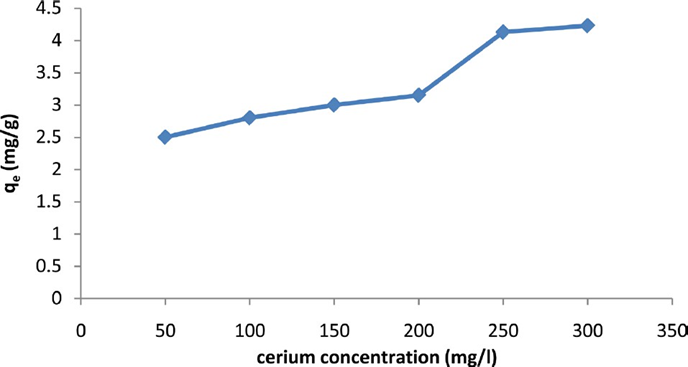
Figura 7. Efectos de la concentración inicial de iones de cerio sobre la adsorción de cerio por el carbón activado(35)
Estudiaron en el año 2016 un novedoso bioadsorbente proveniente de cianobacterias del género Arthrospira comúnmente llamado como spirulina, este material se recolectó de estanques de agua de Israel y se cultivó durante algunos meses donde creció en un Erlenmeyer. El estudio se realizó con el fin de estudiar el tiempo de contacto, el pH, la temperatura y la cantidad de adsorbente para lograr una adecuada adsorción de cerio (lll), las isotermas utilizadas en este estudio fueron Langmuir y Freundlich ambas se ajustaron de la mejor manera obteniendo altos valores de correlación. En definitiva, se pudo deducir por medio del ajuste isotérmico que es posible que la bioadsorción de REE siga un comportamiento intermedio entre un mecanismo de adsorción mono y multicapa.
Akbas, YA et al.(36) Realizaron el estudio de la adsorción de Ce en soluciones acuosas por medio de Orujo de oliva magnético modificado con ácido fosfórico (H₃PO₄) y cloruro de hierro (FeCl₃), este orujo fue recolectado tras la producción de aceite de oliva, el biomaterial se caracterizó por medio de SEM donde se analizó la morfología de la muestra, en la figura 8 se presentó el análisis SEM de nanocompuesto de magnetita-orujo de oliva que al ser modificado se evidenció la presencia de nanopartículas de Fe en distintos tamaños, donde se realiza satisfactoriamente la adhesión de cloruro de hierro en la superficie del orujo. Posteriormente se estudiaron factores importantes como el pH, el tiempo de contacto, la temperatura y la cantidad de adsorbente óptima para la adsorción de Ce, estos valores se encuentran registrados en la tabla 5. Respecto a las isotermas se tomaron en cuenta los modelos de Freundlich y Langmuir donde se encontró que Langmuir fue el que mejor se ajustó a las condiciones del proceso. En último lugar se estudió la termodinámica y se concluyó que el sistema ocurrió endotérmicamente y de forma no espontánea

Figura 8. Análisis de nanocompuesto de magnetita-orujo de oliva
Gao S. et al.(37) estudiaron en el año 2018 la adsorción de Ce por medio de aserrín modificado con ácido poliacrílico, se escogió este material debido a que es un residuo de bajo costo, la modificación se hizo con el fin de mejorar la capacidad de adsorción a los iones metálicos debido a la presencia de grupos de intercambio iónico, se realizaron estudios isotérmicos, termodinámicos y cinéticos con el fin de identificar el pH, el tiempo de contacto y la temperatura óptima en la que el experimento arrojó mejores resultados, el pH se estudió en un rango de 1-7 donde finalmente se encontró que el mejor fue de 6. Por otro lado, se estudiaron las isotermas de Langmuir y Freundlich. Para terminar, se estudió la termodinámica y concluyó un comportamiento endotérmico y espontáneo.
A continuación, en la tabla 5 se encuentra un resumen de los parámetros más importantes de adsorción reportados en la literatura con diferentes adsorbentes. Los valores de las ecuaciones de isoterma reportados por los diferentes autores se encuentra en la tabla 5.
|
Tabla 5. Recopilación de datos obtenidos en el estudio de adsorción de iones de Cerio en soluciones acuosas |
|||||||||
|
Adsorbente |
Ion Cerio |
pH |
Tiempo de equilibrio (min) |
Temperatura |
Cantidad de adsorbente (g) |
Isoterma |
qe (mg/g) |
C0 (mg / L) |
Referencia |
|
Carbón activado a partir de paja de arroz. |
cerio (lV) |
4 |
500 |
35ºC. |
0,02 |
Langmuir |
4,13 |
50-300 |
(35) |
|
Biomasa de espirulina. |
cerio (lll) |
5- 5,5 |
300 |
27°C |
0,1 |
Langmuir, Freundlich |
7,2 |
10 |
(39) |
|
Orujo de oliva magnético. |
cerio (lll) |
6 |
45 |
40°C |
0,04 |
Langmuir |
90,90 |
100 |
(35) |
|
Aserrín modificado. |
cerio (lll) |
6 |
120 |
30°C |
0,02 |
Langmuir, Freundlich |
153,90 |
200 |
(36) |
Adsorción de europio
La adsorción de Eu (III) se realizó mediante un nuevo material ecológico, como lo fue la celulosa funcionalizada con tiourea, la celulosa es la biomolécula más abundante y forma parte de la biomasa terrestre, el material adsorbente funcionalizado se caracterizó mediante el uso de FTIR, se investigó la influencia de los parámetros de adsorción (dosis de adsorbente, tiempo, temperatura y concentración inicial de metal) sobre la capacidad de adsorción dando como resultados, una capacidad máxima de adsorción en los 30 minutos del proceso y una temperatura de 24,8ºC. Se realizaron estudios termodinámicos con el fin de establecer si los procesos de adsorción estudiados son espontáneos o no obteniendo como resultado un proceso espontáneo y endotérmico. Por último, los datos experimentales se ajustaron utilizando dos modelos de isotermas no lineales diferentes, Langmuir y Freundlich, siendo Langmuir el que obtuvo mejores resultados.(38)
Gallardo et al.(30) estudiaron la adsorción de Eu (III) en soluciones acuosas probando la cáscara de nuez (WS) para determinar si este bioadsorbente puede adsorber o no de manera eficiente varios elementos de tierras raras. Para caracterizar el WS antes y después de la adsorción de REE se utilizó espectroscopia FTIR, SEM y termogravimetría. Se ajustaron los valores de pH en experimentos por lotes hasta encontrar que la condición óptima de adsorción fue de pH de 4, los modelos de isotermas comparados en este estudio fueron la de Freundlich, Langmuir y Temkin, todas las isotermas obtuvieron buenos resultados, pero la que más se ajustó y se tomó en cuenta fue Langmuir. Todo el proceso se llevó a cabo a una temperatura de 20ºC.
Kosheleva A et al.(35) ejecutaron un experimento en la adsorción de Eu en base a un adsorbente de biomasa residual de microalgas (Chlorella sorokiniana) más quitosano, el quitosano se extrajo a partir de subproductos del proceso industrial de los crustáceos y concha del cangrejo. Los experimentos se llevaron a cabo por lotes donde la cantidad utilizada de adsorbente fue de 0,1 g, el pH que se estudió fue de 1,54 y 4,24, todo el proceso de adsorción se manejó a temperatura ambiente (20°C) y con un tiempo de contacto de 60 min, donde posteriormente llego al equilibrio donde se estudió las isotermas de adsorción por medio del modelo de Langmuir y Freundlich, como resultado el modelo que mejor se ajustó fue el de Langmuir. Este bioadsorbente fue viable en la adsorción de Eu con una eliminación del ion metálico mayor al 80 %.
Lapo et al.(23) estudiaron en el año 2020 el desempeño de un nuevo adsorbente proveniente de los desechos del banano analizando tres tipos de adsorbentes, raquis de banano (BR), tallo de banano (BPS) y cáscara de banano (BP), los tres dieron muy buenos resultados, pero se recalcó que el BR adsorbió más cantidad de Eu, el experimento se llevó a cabo variando la concentración de Eu en rangos de 10-300 mg/L. Se observó la influencia del pH (2-5), en la figura 9 se puede observar la dependencia del pH con la cantidad de adsorción, se analizó el tiempo de contacto, la cinética y los modelos de isotermas. Las isotermas no lineales estudiadas fueron Langmuir y Freundlich, el modelo que más ajustó fue Langmuir. Respecto a los modelos cinéticos el que más se adaptó fue pseudo segundo orden. Respecto a la caracterización del material se analizó por medio de FTIR y SEM, la morfología para BR presenta simultáneamente una estructura rugosa y homogénea, en conclusión, este adsorbente pertenece al grupo de los que tienen más capacidad de adsorción basándose en la presencia de grupos carboxílicos.

Figura 9. Dependencia del pH con la adsorción de Eu
Shen et al. Realizaron experimentos para la adsorción de Eu utilizando un adsorbente de Serratia marcescens que es un bacilo Gram negativo de la Familia Enterobacteriaceae, este bacilo fue aislado en el laboratorio donde se realizó todo el proceso de adsorción por los mismos autores. Se analizó los parámetros que estuvieron directamente relacionados con la capacidad de adsorción como el pH, el tiempo de contacto, parámetros cinéticos e isotérmicos. Los resultados obtenidos determinaron que cinéticamente el modelo que más se ajustó fue pseudo segundo orden, en la figura 10 se puede observar el comportamiento entre los dos modelos cinéticos. La adsorción fue controlada por quimisorción siendo la isoterma de Langmuir la mejor opción para el proceso. La capacidad de adsorción también depende de la concentración inicial de Eu, en la figura 11 se evidencia que a partir del aumento de la concentración se obtuvieron buenos resultados hasta que llegó a 30 mg /L y la adsorción se mantuvo constante debido a que lo que los sitios de adsorción en el biosorbente estaban saturados con Eu.(39)
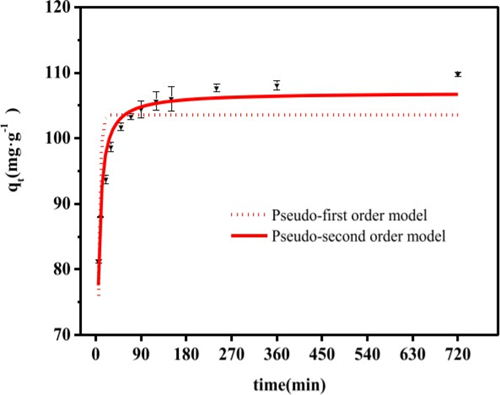
Figura 10. Análisis cinético adsorción de Eu con Serratia marcescens(39)

Figura 11. Concentración inicial de Eu vs la capacidad de adsorción(39)
Si hacemos una comparación de las figuras 10 y 11 encontramos la capacidad de adsorción respecto a la concentración inicial de los iones de Ce y Eu, analizando estas figuras se puede inferir que la adsorción de iones depende mucho de la concentración por lo que es uno de los parámetros importantes a tener en cuenta en el proceso de adsorción, la mayoría de procesos se realizan en un determinado rango de C0, para el Ce no es una excepción y conlleva experimentos entre 50-300 (mg/L) en iones de este elemento, la capacidad de adsorción aumenta al grado que se proporciona más concentración de iones, pero esto no es pertinente porque a lo largo del proceso la adsorción llega a un límite donde permanece constante debido a que los sitios activos del adsorbente se saturan y provoca el colapso de adsorción, por otro lado, la capacidad de adsorción de Eu por Serratia marcescens comienza con la concentración inicial de 10 mg/L hasta llegar a experimentos con concentraciones más altas de 90 mg/L, donde ocurre lo mismo, la adsorción es ineficaz a valores de concentración más altos por lo que los sitios activos se llenan con los iones adsorbidos y no facilita la adsorción, por lo que aumentar la concentración no significa que la eficiencia de adsorción mejore, sino al contrario tiene un límite.
A continuación, en la tabla 6 se encuentra un resumen de los parámetros más importantes de adsorción de Eu reportados en la literatura con diferentes adsorbentes. Los valores de las ecuaciones de isoterma reportados por los diferentes autores se encuentra en la tabla 7.
|
Tabla 6. Recopilación de datos obtenidos en el estudio de adsorción de iones de Europio en soluciones acuosas |
|||||||||
|
Adsorbente |
Ion europio |
pH |
Tiempo de equilibrio (min) |
Temperatura |
Cantidad de adsorbente (g) |
Isoterma |
qe (mg/g) |
C0 (mg / L) |
Referencia |
|
Celulosa funcionaliza da con tiourea. |
Eu (lll) |
Dato no report ado |
30 |
24,8ºC |
0,1 |
Langmuir |
27 |
50 |
(38) |
|
Cáscara de nuez. |
Eu (lll) |
4 |
720 |
20ºC. |
Dato no reportado. |
Langmuir |
6,92 |
Dato no reporta do. |
(30) |
|
Biomasa residual de microalgas más quitosano. |
Eu (lll) |
4,24 |
60 |
20ºC. |
0,1 |
Langmuir, Freundlich . |
31,91 |
10 |
(34) |
|
Raquis de banano. |
Eu (lll) |
4,5 |
50 |
20ºC. |
0,025 |
Langmuir |
100 |
100 |
(23) |
|
Serratia marcescens. |
Eu (lll) |
5 |
120 |
25°C |
0,3 |
Langmuir |
115,36 |
30 |
(39) |
El valor de pH es uno de los parámetros más importantes para el estudio de adsorción en soluciones acuosas ya que su efecto sobre la carga superficial del adsorbente, el grado de ionización, la especie del adsorbato y los grupos funcionales de la superficie influyen en el proceso.(36) Todos los experimentos ocuparon un rango de pH como referencia perteneciente a la escala ácida, esto fue posible debido a la disociación de los grupos carboxilos presentes en el material estudiado (biomasa), como resultados a valores ácidos más altos la adsorción de los metales fue aumentando, posibilitando más sitios disponibles para que ocurriera la adsorción y mejorando la eficiencia de remoción.
El tiempo de contacto fue necesario para realizar el estudio cinético del proceso, junto con la temperatura y la cantidad de adsorbente, estos tienen una gran influencia en la eficiencia en la adsorción de iones metálicos, el aumento del tiempo de contacto y la temperatura no significó una alta eficiencia en la remoción de los iones.
Para el estudio de equilibrio es indispensable utilizar modelos de isotermas para darnos idea de cómo ocurre el mecanismo de adsorción, en la literatura revisada se pudo notar una gran eficiencia en los modelos de Langmuir y Freundlich siendo las ecuaciones no lineales las que más se ajustaron a los experimentos, el resumen de los parámetros en las ecuaciones de isotermas reportados por los diferentes autores se encuentra en la tabla 7. Langmuir tiene una gran ventaja debido a que su mecanismo ocurre en monocapa en superficie homogénea y su reacción pertenece a quimisorción lo que hace que las moléculas de adsorbato se adsorban solo en los sitios de adsorción de los adsorbentes logrando que las moléculas tengan la misma energía de activación. Por otro lado, Freundlich asume su mecanismo en multicapa y en superficies heterogéneas los resultados de los parámetros de la ecuación se hallaron por medio de regresión no lineal. Por último, se hace una comparación entre estos dos modelos con el fin de describir cual refleja el mayor rendimiento de los adsorbentes. Las isotermas generalmente representan la relación de equilibrio entre el adsorbato adsorbido en la superficie y la cantidad de adsorbato en la solución.(34)
|
Tabla 7. Resumen de los parámetros en las ecuaciones de isotermas reportados por los diferentes autores |
||||||||||||
|
Adsorbente |
Ion |
Modelo Langmuir |
Modelo Freundlich |
Modelo Temkin |
Referencia |
|||||||
|
|
|
qm (mg/g) |
bL (L/mg) |
R2 |
kf (L/mg) |
n |
R2 |
kT (kJ/ mol) |
bT |
R2 |
|
|
|
Corteza de durián |
La (III) |
71 |
38,8 |
Dato no reportado |
- |
- |
- |
- |
- |
- |
(33) |
|
|
Biocarbón derivado de paja de trigo |
La (III) |
242,51 71 |
0,0238 |
0,9895 |
- |
- |
- |
- |
- |
- |
(32) |
|
|
Biomasa residual de microalgas con quitosano y cascarilla de mijo. |
La (III) |
4,28 |
Dato no reporta do |
0,999 |
- |
- |
- |
- |
- |
- |
(34) |
|
|
Carbón activado a partir de paja de arroz. |
cerio (lV) |
5,12 |
0,012 |
0,913 |
- |
- |
- |
- |
- |
- |
(35) |
|
|
Orujo de oliva magnético. |
cerio (lll) |
93,984 |
0,0024 |
Dato no reportado |
- |
- |
- |
- |
- |
- |
(36) |
|
|
Celulosa funcionaliza da con tiourea. |
Eu (lll) |
32,27 |
0,052 |
0,9914 |
- |
- |
- |
- |
- |
- |
(38) |
|
|
Cáscara de nuez. |
Eu (lll) |
5,689 |
0,214 |
0,999 |
- |
- |
- |
- |
- |
- |
(30) |
|
|
Biomasa residual de microalgas más quitosano. |
Eu (lll) |
1,74 |
Dato no reporta do |
0,991 |
- |
- |
- |
- |
- |
- |
(34) |
|
|
Raquis de banano. |
Eu (lll) |
85,49 |
0,07 |
0,87 |
- |
- |
- |
- |
- |
- |
(23) |
|
|
Serratia marcescens. |
Eu (lll) |
116,30 38 |
0,2815 7 |
0,9947 7 |
- |
- |
- |
- |
- |
- |
(39) |
|
|
Aserrín modificado. |
cerio (lll) |
155,38 |
1,2302 |
Dato no reportado |
71,9 666 |
5,2 092 |
Dato no reportado |
- |
- |
- |
(37) |
|
|
Biomasa de espirulina. |
cerio (lll) |
- |
- |
- |
1,26 |
2,51 |
Dato no reportado |
|
|
|
(40) |
|
|
Cáscara de nuez |
La (III) |
- |
- |
- |
11,3 46 |
6,6 18 |
0,999 |
- |
- |
- |
(30) |
|
|
Pectina extraída de la cáscara del durian |
La (III) |
- |
- |
- |
1,14 6 |
4,1 2 |
Dato no reportado |
0,387 |
3,268 |
Dato no reportado |
(31) |
|
Entre los adsorbentes estudiados con mayor capacidad de adsorción se encuentra el biocarbón derivado de paja de trigo, el orujo de oliva magnético, serratia marcescens y el aserrín modificado, teniendo grandes ventajas para futuras investigaciones en la adsorción de iones de La, Ce y Eu, se podría decir que la capacidad de eliminación y recuperación por medio de estos bioadsorbentes es óptimo y nos ayuda a tener amplia idea de la ocupación de biomasa como alternativa medioambiental aprovechando que la mayoría de estos materiales los podemos encontrar con mayor facilidad y su costo no es tan alto, el estudio de la literatura revela que estos tipos de adsorbentes mayormente siguen un modelo de isoterma de Langmuir en monocapa y de naturaleza química en otras palabras quimisorción, un proceso irreversible formado por enlaces químicos covalentes entre las moléculas adsorbidas.
Para la recuperación de los bioadsorbentes se realizó el proceso de desorción y purificación donde se tuvo en cuenta que la gran mayoría de materiales estudiados sirven para realizar diferentes pruebas, lo que quiere decir que son materiales que se pueden reutilizar disminuyendo los costos operativos en futuras investigaciones
Realizando una comparación de los elementos de tierras raras con un biosorbente derivado de la cáscara del café para la eliminación eficiente de iones de metales pesados tóxicos como el plomo y el cadmio de las aguas residuales se puede evidenciar que el proceso de adsorción también se realiza de manera satisfactoria, Quyen et al.(41) realizaron el estudio convirtiendo el material de biomasa en biosorbentes con un enfoque práctico para producir un adsorbente eficiente, de valor agregado y de bajo costo, los desechos del café se encuentran en gran cantidad y pueden ser potencialmente eficientes debido a sus estructuras únicas y características fisicoquímicas. Gráficamente el proceso del adsorbente se describe en la figura 12.
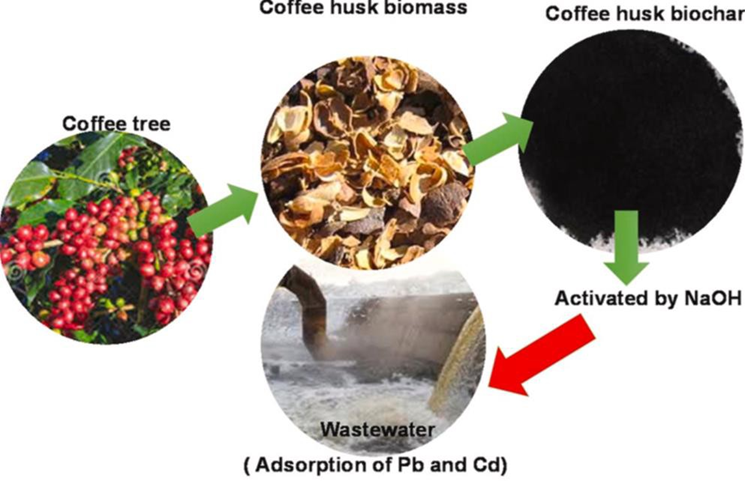
Figura 12. Proceso de obtención del adsorbente(41)
Investigaron los parámetros fundamentales de adsorción como el pH, tiempo de contacto, la concentración inicial, los modelos cinéticos e isotérmicos. El rango de pH estudiado fue de 2- 7 con un tiempo de contacto de 90 minutos, como resultado el estudio siguió el modelo de Freundlich y el modelo cinético de segundo orden, con una capacidad máxima de adsorción de Cd de 116,3 (mg / g) y Pb 139,5 (mg /g), finalmente se comprobó que el material se podría reutilizar y contribuye eficientemente en la adsorción de iones metálicos pesados en la descontaminación de aguas.
Por último, se presenta una comparación en los modelos de isotermas estudiados por Quyen et al.(41) en la tabla 8. Donde se expone que el modelo que más se acopla a la eliminación de metales pesados es Freundlich.
|
Tabla 8. Parámetros de isotermas |
||||||
|
Metales pesados |
Modelo Langmuir |
Modelo Freundlich |
||||
|
qm |
bL |
R2 |
Kf |
n |
R2 |
|
|
Cd2+ |
116,3 |
0,26 |
0,82 |
0,51 |
0,34 |
0,95 |
|
Pb2+ |
139,5 |
0,18 |
0,86 |
0,41 |
0,58 |
0,97 |

Figura 13. Gráfico de Arrhenius para la adsorción de Eu por celulosa funcionalizada
En el estudio cinético y de energía de activación de la adsorción de Eu por Celulosa funcionalizada con tiourea se evidenció que la temperatura también influye en la capacidad máxima de adsorción de la celulosa modificada por lo cual se concluyó que los procesos de adsorción de iones Eu se describieron mejor mediante el modelo cinético de pseudo-segundo orden, posteriormente con la constante de velocidad hallada realizaron el gráfico de Arrhenius para encontrar el valor de la energía de activación, Negrea et al.(38) encontraron que la adsorción de iones de Eu necesita una energía de activación de 2,99 x10−3 kJ /mol. La figura 13 representa la gráfica de Arrhenius que reportaron los autores de esa investigación.(42,43)
Los parámetros termodinámicos y modelos cinéticos analizados de los pocos autores que presentaron esta información en sus respectivos estudios de adsorciones se representan en la tabla 9. Este estudio no se realiza en la mayoría de los artículos, debido a su complejidad y su exhausto análisis.(44,45)
Los estudios termodinámicos se realizan con el fin de evaluar la espontaneidad del proceso, para esto se calcula el cambio en la energía de Gibbs donde podemos analizar que a valores negativos ocurre espontáneamente, a valores positivos el proceso ocurre no espontáneo en el sentido que no existirá formación en productos, cuando el valor es cero en el cambio de la energía libre de Gibbs se dice que el sistema se encuentra en estado equilibrio y tanto reactivos y productos permanecen constantes.
|
Tabla 9. Lista de parámetros termodinámicos y modelos cinéticos para la adsorción de REE en diferentes adsorbentes |
|||||||
|
Adsorbente |
REE |
Temperatura ºC |
Δ H°(kJ / mol) |
Δ S°(J /mol ∙ K) |
Δ G°(kJ / mol) |
Cinética |
Referencia |
|
Celulosa funcionalizada con tiourea. |
Eu (lll) |
25 |
1,87 |
8,33 |
−0,608 |
pseudo-segundo orden |
(38) |
|
Biocarbón derivado de paja. |
La (lll) |
20 |
35,39 |
104,71 |
−40,04 |
pseudo-segundo orden |
(32) |
|
Pectina extraída de la cáscara del durian. |
La (lll) |
25 |
0,012 |
0,02 |
-6,2 |
pseudo-segundo orden |
(31) |
|
Orujo de oliva magnético |
Cerio (lll) |
40 |
7,4495 |
0,0081 |
4,9081 |
pseudo-segundo orden |
(36) |
|
Aserrín modificado |
cerio (lll) |
30 |
16,66 |
65,35 |
- 3,12 |
pseudo-segundo orden |
(37) |
Analizando la tabla 9 en los valores de la energía libre de Gibbs se puede apreciar que todos los adsorbentes excepto el Orujo de oliva magnético ocurren de manera espontánea. El cambio de entalpía estándar nos proporcionó evaluar si el proceso absorbía o liberaba energía, para toda la literatura se observó que el proceso era endotérmico existiendo una transferencia de calor al sistema desde el entorno. El valor de la entropía determinó el desorden del sistema, si eran positivos indicó un grado mayor de desorden, el adsorbente que menor desorden en el sistema obtuvo fue el Orujo de oliva magnético.
CONCLUSIONES
La revisión bibliográfica llevada a cabo demostró que la adsorción es uno de los métodos más prometedores debido a su alta eficiencia y pocos gastos operacionales para la eliminación de Lantano, Cerio y Europio en soluciones acuosas, determinando la importancia en la evaluación de variables como el tiempo de contacto, el pH, y la temperatura.
La remoción de La y Eu basado en la recopilación de información de Gallardo et al.(33) se encontró que a un pH de 4 la adsorción fue de 87 % para Eu y 85 % para La, ellos reportan que esto ocurrió debido al alto contenido de carbono de la cáscara de nuez que fue el adsorbente.
La adsorción de La por medio del adsorbente de corteza de durian alcanzó su máxima capacidad a un pH de 4 con un 72,8 % de remoción.
Sadovsky et al.(40) reportaron que la cantidad de adsorción de Ce a un pH de 5 fue del 90 %, para la recuperación del adsorbente se realizaron tres ciclos de adsorción – desorción donde la recuperación fue del 97 % de biomasa de espirulina, esto relaciona su buena utilidad como bioadsorbente y la viabilidad para la recuperación de iones de Ce.
El bioadsorbente de biomasa residual de microalgas con quitosano y cascarilla de mijo para la remoción de La con un pH de 4 resultó ser de más del 80 % de adsorción.(34)
En general la capacidad de adsorción por medio de bioadsorbentes fue muy eficaz y se puede concluir que la capacidad de remoción para la mayoría de los iones de La, Ce y Eu fueron de más del 70 %.
En los estudios cinéticos se realizaron los modelados para determinar cuál paso controló la velocidad de remoción, éste puede ser la transferencia de masa externa, la difusión interna o la adsorción; en la mayoría de la literatura, la cinética fue controlada en el paso de adsorción por lo que se logró identificar que el modelo de pseudo-segundo orden aportó un mayor ajuste, conduciendo a la conclusión de que la mayoría de experimentos que se llevaron a cabo fueron gobernados por fenómenos de Quimi sorción.
Para el modelado de las isotermas de adsorción, la literatura estudiada reveló que los modelos de Langmuir y Freundlich se ajustaban más a los procesos, con R2 de más de 0,9, el primero se caracterizó por adsorción en monocapa con superficies homogéneas, mientras, el modelo de Freundlich se caracterizó por adsorciones que ocurrieron en multicapa y de forma heterogénea. Los adsorbentes que se rigieron por el modelo de Langmuir son, la corteza de durián, biocarbón derivado de paja de trigo, biomasa residual de microalgas con quitosano y cascarilla de mijo, carbón activado a partir de paja de arroz, orujo de oliva magnético, celulosa funcionalizada con tiourea, cáscara de nuez, biomasa residual de microalgas más quitosano, raquis de banano y serratia marcescens.
Se logró evaluar la dependencia de los parámetros termodinámicos y su importancia, la mayoría de la literatura estudiada demostró que la adsorción es un fenómeno espontáneo y endotérmico excepto para el adsorbente de orujo de oliva, donde el sistema absorbió energía térmica de su entorno.
De manera que se puede concluir que el proceso de adsorción por medio de materia orgánica y carbón activado es una alternativa eficaz y novedosa que demuestra una gran adsorción de iones de La, Ce y Eu en soluciones acuosas, pudiéndose aplicar en tratamiento de aguas residuales contaminadas con tierras raras y ayudar a la recuperación de estos metales buscando la remediación ambiental.
REFERENCIAS BIBLIOGRÁFICAS
1. Jaireth S, Hoatson DM, Miezitis Y. Geological setting and resources of the major rare-earth-element deposits in Australia. Ore Geol Rev. 2014;62:72-128. https://doi.org/10.1016/j.oregeorev.2014.02.008
2. Moldoveanu GA, Papangelakis VG. Recovery of rare earth elements adsorbed on clay minerals: I. Desorption mechanism. Hydrometallurgy. 2012;117-118:71-8. https://doi.org/10.1016/j.hydromet.2012.02.007
3. Anastopoulos I, Bhatnagar A, Lima EC. Adsorption of rare earth metals: A review of recent literature. J Mol Liq. 2016;221:954-62. https://doi.org/10.1016/j.molliq.2016.06.076
4. Binnemans K, Jones PT, Blanpain B, van Gerven T, Yang Y, Walton A, et al. Recycling of rare earths: A critical review. J Clean Prod. 2013;51:1-22. https://doi.org/10.1016/j.jclepro.2012.12.037
5. Liu S, Fan HR, Yang KF, Hu FF, Wang KY, Chen FK, et al. Mesoproterozoic and Paleozoic hydrothermal metasomatism in the giant Bayan Obo REE-Nb-Fe deposit. Precambrian Res. 2018;311:228-46. https://doi.org/10.1016/j.precamres.2018.04.021
6. Liu T, Chen J. Extraction and separation of heavy rare earth elements: A review. Sep Purif Technol. 2021;276:119263. https://doi.org/10.1016/j.seppur.2021.119263
7. Jowitt SM, Werner TT, Weng Z, Mudd GM. Recycling of the rare earth elements. Curr Opin Green Sustain Chem. 2018;13:1-7. https://doi.org/10.1016/j.cogsc.2018.02.008
8. Mancheri NA, Sprecher B, Bailey G, Ge J, Tukker A. Effect of Chinese policies on rare earth supply chain resilience. Resour Conserv Recycl. 2019;142:101-12. https://doi.org/10.1016/j.resconrec.2018.11.017
9. Dushyantha N, Batapola N, Ilankoon IMSK, Rohitha S, Premasiri R, Abeysinghe B, et al. The story of rare earth elements (REEs): Occurrences, global distribution, genesis, geology, mineralogy and global production. Ore Geol Rev. 2020;122:103521. https://doi.org/10.1016/j.oregeorev.2020.103521
10. Villela Olavarría D, Donoso Rojas F, Cantallopts Araya J. Situación actual del mercado de tierras raras y su potencial en Chile. 2016.
11. King H. REE - Rare Earth Elements and their Uses. 2017.
12. Willbold M. Europium. In: White WM, editor. Encyclopedia of Geochemistry: A Comprehensive Reference Source on the Chemistry of the Earth. Springer International Publishing; 2018. p. 462-4. https://doi.org/10.1007/978-3-319-39312-4_99
13. Chauvel C. Cerium. In: White WM, editor. Encyclopedia of Geochemistry: A Comprehensive Reference Source on the Chemistry of the Earth. Springer International Publishing; 2018. p. 226-9. https://doi.org/10.1007/978-3-319-39312-4_88
14. Chauvel C. Encyclopedia of Geochemistry. In: White WM, editor. Springer International Publishing; 2018. https://doi.org/10.1007/978-3-319-39312-4
15. Mozaffari Majd M, Kordzadeh-Kermani V, Ghalandari V, Askari A, Sillanpää M. Adsorption isotherm models: A comprehensive and systematic review (2010−2020). Sci Total Environ. 2021;151334. https://doi.org/10.1016/j.scitotenv.2021.151334
16. Zhang D, Qu R, Zhang H, Zhang F. Differentiation of chemisorption and physisorption of carbon dioxide on imidazolium-type poly(ionic liquid) brushes. J Wuhan Univ Technol Mater Sci Ed. 2020;35(4):750-7. https://doi.org/10.1007/s11595-020-2317-2
17. Wang J, Guo X. Adsorption isotherm models: Classification, physical meaning, application and solving method. Chemosphere. 2020;258:127279. https://doi.org/10.1016/j.chemosphere.2020.127279
18. Niño Arias IV, Ortíz Ramírez D. Evaluación de dos clases de carbón activado granular para su aplicación efectiva en la remoción de fenoles en los vertimientos de una empresa de jabones. Bogotá: Universidad de La Salle; 2008. https://ciencia.lasalle.edu.co/ing_ambiental_sanitaria
19. Paul Nayagam JO, Prasanna K. Utilization of shell-based agricultural waste adsorbents for removing dyes: A review. Chemosphere. 2021;132737. https://doi.org/10.1016/j.chemosphere.2021.132737
20. Tran HN, Lima EC, Juang RS, Bollinger JC, Chao HP. Thermodynamic parameters of liquid-phase adsorption process calculated from different equilibrium constants related to adsorption isotherms: A comparison study. J Environ Chem Eng. 2021;9(6):106674. https://doi.org/10.1016/j.jece.2021.106674
21. Geankoplis CJ. Procesos de transporte y operaciones unitarias.
22. Can N, Ömür BC, Altındal A. Modeling of heavy metal ion adsorption isotherms onto metallophthalocyanine film. Sens Actuators B Chem. 2016;237:953-61. https://doi.org/10.1016/j.snb.2016.07.026
23. Lapo B, Bou JJ, Hoyo J, Carrillo M, Peña K, Tzanov T, et al. A potential lignocellulosic biomass based on banana waste for critical rare earths recovery from aqueous solutions. Environ Pollut. 2020;264. https://doi.org/10.1016/j.envpol.2020.114409
24. Largitte L, Pasquier R. A review of the kinetics adsorption models and their application to the adsorption of lead by an activated carbon. Chem Eng Res Des. 2016;109:495-504. https://doi.org/10.1016/j.cherd.2016.02.004
25. Lapo B, Demey H, Carchi T, Sastre AM. Antimony removal from water by a chitosan-iron(III) biocomposite. Polymers. 2019;11(2). https://doi.org/10.3390/polym11020351
26. Chen Y, Tang J, Wang S, Zhang L. High selectivity and reusability of coordination polymer adsorbents: Synthesis, adsorption properties and activation energy. Microporous Mesoporous Mater. 2021;324:111309. https://doi.org/10.1016/j.micromeso.2021.111309
27. Mozaffari Majd M, Kordzadeh-Kermani V, Ghalandari V, Askari A, Sillanpää M. Adsorption isotherm models: A comprehensive and systematic review (2010−2020). Sci Total Environ. 2021;151334. https://doi.org/10.1016/j.scitotenv.2021.151334
28. Zaheer Z, Al-Asfar A, Aazam ES. Adsorption of methyl red on biogenic Ag@Fe nanocomposite adsorbent: Isotherms, kinetics and mechanisms. J Mol Liq. 2019;283:287-98. https://doi.org/10.1016/j.molliq.2019.03.030
29. Arroyo Ramírez LD-RRDM. Determinación de la cinética de adsorción de cloruros de vertimientos del sector agrícola cultivos energéticos, sobre carbón activado comercial. 2018.
30. Gallardo K, Castillo R, Mancilla N, Remonsellez F. Biosorption of Rare-Earth Elements From Aqueous Solutions Using Walnut Shell. Front Chem Eng. 2020;2. https://doi.org/10.3389/fceng.2020.00004
31. Kusrini E, Usman A, Sani FA, Wilson LD, Abdullah MAA. Simultaneous adsorption of lanthanum and yttrium from aqueous solution by durian rind biosorbent. Environ Monit Assess. 2019;191(8). https://doi.org/10.1007/s10661-019-7634-6
32. Zhao Q, Wang Y, Xu Z, Yu Z. The potential use of straw-derived biochar as the adsorbent for La(III) and Nd(III) removal in aqueous solutions. Environ Sci Pollut Res. https://doi.org/10.1007/s11356-021-13988-2
33. Kusrini E, Wicaksono W, Gunawan C, Daud NZA, Usman A. Kinetics, mechanism, and thermodynamics of lanthanum adsorption on pectin extracted from durian rind. J Environ Chem Eng. 2018;6(5):6580-8. https://doi.org/10.1016/j.jece.2018.10.018
34. Kosheleva A, Atamaniuk I, Politaeva N, Kuchta K. Adsorption of rare earth elements using bio-based sorbents. MATEC Web Conf. 2018;245. https://doi.org/10.1051/matecconf/201824518001
35. Farahmand E. Adsorption of Cerium (IV) from Aqueous Solutions Using Activated Carbon Developed from Rice Straw. Open J Geol. 2016;6(3):189-200. https://doi.org/10.4236/ojg.2016.63017
36. Akbas YA, Yusan S, Sert S, Aytas S. Sorption of Ce(III) on magnetic/olive pomace nanocomposite: isotherm, kinetic and thermodynamic studies. Environ Sci Pollut Res Int. 2021. https://doi.org/10.1007/s11356-021-14662-3
37. Gao S, Luo T, Zhou Q, Luo W. A novel and efficient method on the recovery of nanosized CeO2 in Ce3+ wastewater remediation using modified sawdust as adsorbent. J Colloid Interface Sci. 2018;512:629-37. https://doi.org/10.1016/j.jcis.2017.09.032
38. Negrea A, Gabor A, Davidescu CM, Ciopec M, Negrea P, Duteanu N, et al. Rare Earth Elements Removal from Water Using Natural Polymers. Sci Rep. 2018;8(1). https://doi.org/10.1038/s41598-017-18623-0
39. Shen J, Liang C, Zhong J, Xiao M, Zhou J, Liu J, et al. Adsorption behavior and mechanism of Serratia marcescens for Eu(III) in rare earth wastewater. Environ Sci Pollut Res. 2021. https://doi.org/10.1007/s11356-021-14668-x
40. Sadovsky D, Brenner A, Astrachan B, Asaf B, Gonen R. Biosorption potential of cerium ions using Spirulina biomass. J Rare Earths. 2016;34(6):644-52. https://doi.org/10.1016/S1002-0721(16)60074-1
41. Quyen VT, Pham TH, Kim J, Thanh DM, Thang PQ, van Le Q, et al. Biosorbent derived from coffee husk for efficient removal of toxic heavy metals from wastewater. Chemosphere. 2021;284. https://doi.org/10.1016/j.chemosphere.2021.131312
42. Bharathi KS, Ramesh ST. Removal of dyes using agricultural waste as low-cost adsorbents: a review. Appl Water Sci. 2013;3(4):773-90. https://doi.org/10.1007/s13201-013-0117-y
43. Moses CO. Enthalpy and Entropy. In: White WM, editor. Encyclopedia of Geochemistry. Springer International Publishing; 2018. https://doi.org/10.1007/978-3-319-39312-4
44. Charnley SB. Chemisorption. In: Gargaud M, Amils R, Cernicharo Quintanilla J, Cleaves HJ, Irvine WM, Pinti DL, et al., editors. Encyclopedia of Astrobiology. Berlin, Heidelberg: Springer; 2015. https://doi.org/10.1007/978-3-662-44185-5_270
45. Zhu Y, Zheng Y, Wang A. A simple approach to fabricate granular adsorbent for adsorption of rare elements. Int J Biol Macromol. 2015;72:410-20. https://doi.org/10.1016/j.ijbiomac.2014.08.039
FINANCIACIÓN
Los autores no recibieron financiación para el desarrollo de la presente investigación.
CONFLICTO DE INTERESES
Los autores declaran que no existe conflicto de intereses.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Roxana Alejandra Ramirez Moriano, Jacqueline Corredor Acuña.
Curación de datos: Roxana Alejandra Ramirez Moriano, Jacqueline Corredor Acuña.
Análisis formal: Roxana Alejandra Ramirez Moriano, Jacqueline Corredor Acuña.
Redacción – borrador original: Roxana Alejandra Ramirez Moriano, Jacqueline Corredor Acuña.
Redacción – revisión y edición: Roxana Alejandra Ramirez Moriano, Jacqueline Corredor Acuña.